Resumen de servicios de cumplimiento con el IVDR de la UE
El reglamento europeo de diagnóstico in vitro (IVDR de la UE) es una nueva base normativa para incorporar los IVD en el mercado europeo. El reglamento IVDR de la UE remplazará la directiva actual sobre productos sanitarios para diagnóstico in vitro (UE 98/79/CE). Al ser una normativa europea, será efectiva en todos los Estados miembros de la UE y de la Asociación Europea de Libre Comercio (AELC) sin necesidad de transferirla a las leyes de cada Estado. Como socio normativo comprobado, Freyr le brinda a los fabricantes servicios de cumplimiento con el IVDR de la UE y servicios de consultoría sobre el IVDR para cumplir con las normativas de diagnóstico in vitro y el marcado CE.
Agende una reunión con los expertos en IVDR de la UE
El reglamento IVDR - Calendario de transición
El nuevo IVDR de la UE debe entrar en vigor el 26 de mayo de 2022 y se lo considera un cambio importante en la supervisión de la normativa de los IVD. Resumen de la transición del IVDR:
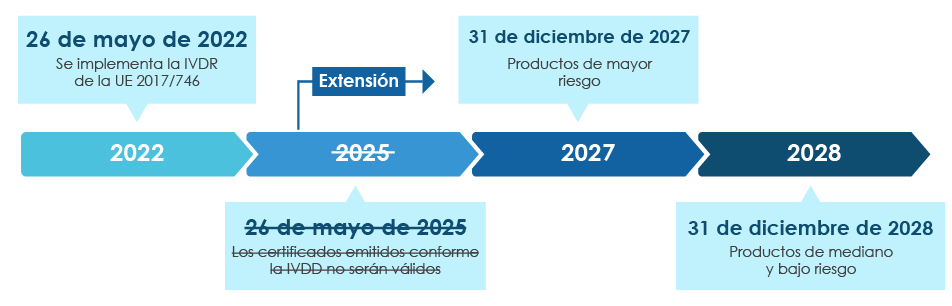
Una vez que se implementen por completo, las reglas de cumplimiento del IVDR garantizarán que casi todos los IVD que ingresen al mercado europeo estén sujetos a la revisión del organismo notificado (NB) del IVDR y a la certificación de marcado CE como parte del proceso de aprobación IVD. En este contexto, además de alinearse con la clasificación IVDR actualizada, hay un requisito inmediato para que los fabricantes revisen de manera efectiva la documentación técnica clave para un registro IVD y marcado CE exitosos. Los requisitos del IVDR varían según la clasificación de riesgo del IVD. En general, para obtener la certificación IVD, los fabricantes deben realizar lo siguiente:
- Revisiones de ficha técnica según la normativa del IVDR (reglamento de la UE 2017/746).
- Preparación del informe de evaluación del funcionamiento (PER) para todos los IVD.
- Seguimiento del funcionamiento poscomercialización(PMPF) según el anexo XIII parte B del IVDR.
- Informes de vigilancia según el artículo 82 del IVDR.
Freyr ayuda a sus clientes a llevar a cabo revisiones sistemáticas de la bibliografía científica y en la planificación y preparación del informe PER para el cumplimiento de la normativa de diagnóstico in vitro. Freyr cuenta con expertos que ofrecen servicios de consultoría sobre el IVDR y ayudan en el seguimiento poscomercialización (PMS), una parte integral del sistema de gestión de calidad del fabricante junto con el seguimiento del funcionamiento poscomercialización.
LA EXPERIENCIA DE FREYR
- Plan de transición para cumplir con el IVDR.
- Revisión técnica y análisis de brecha de los requisitos del IVDR para los requisitos generales de seguridad y funcionamiento (GSPR).
- Ayuda en la recopilación de la ficha técnica según los requisitos del IVDR.
- Informes con validez científica basados en bibliografía o información interna.
- Informes de funcionamiento clínico basados en bibliografía o información interna.
- Informes de pruebas clínicas o de evaluaciones de funcionamiento.
- Protocolos e informes del seguimiento del funcionamiento poscomercialización (PMPF).
- Protocolos e informes del seguimiento poscomercialización (PMS).
- Escritura o revisión de otros documentos como el folleto o las instrucciones de uso, las instrucciones de referencia rápida, manual de operación o de usuario, etc.
VENTAJAS DE FREYR
- Cumplimiento del IVDR, registro del IVD y marcado CE garantizados.
- Gran conocimiento de la normativa y experiencia en las zonas de impacto principales del IVDR de la UE.
- Gran modelo de entrega motivado por la gestión de proyectos para garantizar el cumplimiento de la agenda.
- Expertos en organismos notificados (revisión del informe por los evaluadores interactivos del organismo notificado).
- Equipos enfocados con experiencia diversa en zonas de impacto específicas y categorías de productos.
- Contribuciones multidisciplinarias de expertos en productos sanitarios para cumplir con los requisitos.
- Gran alcance del servicio en el cumplimiento, la revisión y la planificación.
- Gran experiencia en mantener la regularidad de las entregas (tiempo y calidad).
Para obtener ayuda de principio a fin sobre el IVDR de la UE, contáctese con Freyr.