Resumen de registro de productos sanitarios CDSCO en India
La India es uno de los principales mercados de productos sanitarios del mundo por su gran contribución en importación de productos. La Organización central de control de estándares de fármacos (CDSCO) regula los productos sanitarios y los diagnósticos in vitro (IVD) comercializados en India. La CDSCO está comandada por el Controlador general de fármacos de la India (DCGI) y la autoridad de aprobación se comparte entre la Autoridad central de licencias (CLA) y la Autoridad estatal de licencias (SLA). El registro de productos sanitarios CDSCO de la India requiere el cumplimiento de distintas normativas respecto a la clasificación de los productos y las normas de seguridad de los pacientes.
Autoridad reguladora: Organización central de control de estándares de fármacos (CDSCO).
Regulación: Reglas de productos sanitarios, 2017.
Vías de regulación: Listado o registro de los productos.
Representante autorizado: Agente autorizado de la India (IAA) requerido para productos notificados y sin notificar.
Requisitos de sistema de gestión de la calidad: Parte 5 del MDR 2017/ ISO 13485:2016
Evaluación de información técnica: CDSCO u organismos notificados acreditados por la CDSCO.
Validez de la licencia: Ilimitada.
Requisitos de etiquetado: Capítulo VI del MDR 17, Legal Metrology Act.
Formato de entrega: Electrónico.
Idioma: Inglés
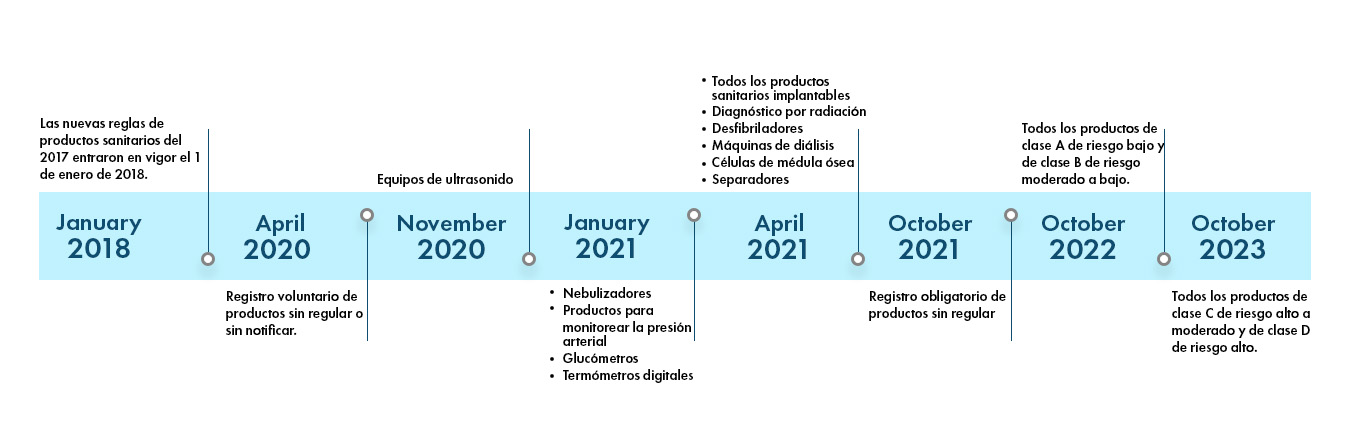
Los reglamentos de productos sanitarios de la India son dinámicos y se vuelven más estrictos cada día. Hay 37 categorías de productos que actualmente son notificados y regulados por la CDSCO en India. Se incluirán más categorías de productos para el control de la CDSCO en los próximos años. El panorama normativo de la India es el siguiente:
Clasificación de productos sanitarios en India
Existen sistemas de clasificación diferenciados para los productos sanitarios y los productos de diagnóstico in vitro (IVD). Cada categoría se divide en 4 clases según el alcance del riesgo asociado con los productos.
|
Clase de producto |
Riesgo |
|
A |
Riesgo bajo |
|
B |
Riesgo bajo a moderado |
|
C |
Riesgo moderado a alto |
|
D |
Riesgo alto |
Agente autorizado de la India (IAA)
Los fabricantes extranjeros deben designar un agente autorizado de la India (IAA) para comercializar productos en India. El IAA debe tener una licencia activa para comercialización de fármacos al por mayor según los formularios 20B y 21B. Los fabricantes extranjeros pueden designar a sus distribuidores o importadores como sus IAA. Sin embargo, contar con un IAA independiente sin intereses comerciales puede brindar flexibilidad para designar distintos distribuidores en India. Haga clic aquí para ver las preguntas más frecuentes sobre la designación de IAA.
Registro de productos sanitarios en India
Todas las solicitudes para productos notificados y sin notificar se deben enviar a través de la página web SUGAM ya que la CDSCO gestiona las solicitudes en ese portal.
Productos sin notificar: Los productos que no aparecen en la lista de productos notificados no están regulados en India. Sin embargo, estos productos se pueden registrar en el portal de la CDSCO. Los fabricantes extranjeros deben contar con un IAA radicado en India para comercializar los productos.
Productos notificados: Hay 37 categorías de productos registrados en la lista de notificados que están regulados por la CDSCO y requieren de la aprobación previa de la CDSCO para comercializarse en India. Hay distintos tipos de formularios y los requisitos de documentación varían según el formulario de solicitud enviado a la CDSCO.
La elección del formulario depende de la aprobación del país de origen, la disponibilidad del certificado de venta libre (FSC), la naturaleza del solicitantes, las operaciones y el tipo de producto. Después de una evaluación detallada de las solicitudes, la CDSCO emite licencias tanto para probar, importar o para fabricar los productos.
|
Operación prevista |
Fabricante indio (planta propia) |
Fabricante indio (planta ajena) |
Fabricante extranjero |
|
Fabricación del producto par ala distribución o la venta. |
Licencia de fabricación. |
Licencia de fabricación. |
N/A |
|
Fabricación o importación del producto para prueba. |
Licencia de prueba. |
Licencia de prueba. |
Licencia de prueba. |
|
Importación del producto para la distribución en India (con aprobación del país de referencia). |
N/A |
N/A |
Licencia de importación sin la evaluación técnica SEC. |
|
Importación del producto para la distribución en India (con aprobación del país de referencia o FSC). |
N/A |
N/A |
Licencia de importación con la evaluación técnica SEC. |
Resumen del proceso de aprobación de la normativa
Clase A NSNM
- Designe un importador para gestionar el registro y la importación del producto en India. El importador debe contar un una licencia válida de venta al por mayor (formulario 20B/21B o formulario 41) o dar una justificación válida para no tener licencia.
- El importador debe tener una cuenta en el portal de la CDSCO.
- Declaración jurada.
- Registro obligatorio del producto en el portal de la CDSCO.
- Comercialización de los productos e IVD aprobados en India.
Clase A
- Designe un agente autorizado en India para representarlo en las interacciones con la CDSCO. Para gestionar el registro y la importación del producto en India, el agente autorizado debe tener una licencia válida para venta al por mayor (formularios 20B y 21B/21C) y un poder legal.
- El IAA debe tener una cuenta en el portal de la CDSCO.
- Para los productos de países sin referencia, la licencia de clase B requiere la verificación de seguridad y funcionamiento a través de la información publicada o la investigación clínica y un certificado de venta libre del país de origen.
- Recopilación de la solicitud del producto (formulario MD-14), incluyendo y sin limitarse a la información de la planta de fabricación, la información técnica del producto, el certificación ISO 13485 y las instrucciones de uso.
- La solicitud de la licencia de registro o importación se debe presentar con la CDSCO junto con las tasas pertinentes y la documentación en inglés.
-
- La CDSCO evalúa las solicitudes y puede solicitar una presentación técnica.
- Un comité experto en el área (SEC) evalúa los productos nuevos.
- La CDSCO otorga una licencia de importación sin fecha de vencimiento a través del formulario MD-15. Por otro lado, los cargos para la retención de la licencia se abonan cada cinco años.
- Una vez autorizado por la CDSCO, el agente autorizado designado en la India (IAA) puede importar productos.
- Comercialización de los productos e IVD aprobados en India.
Clase B
- Designe un agente autorizado en India para representarlo en las interacciones con la CDSCO. Para gestionar el registro y la importación del producto en India, el agente autorizado debe tener una licencia válida para venta al por mayor (formularios 20B y 21B/21C) y un poder legal.
- El IAA debe tener una cuenta en el portal de la CDSCO.
- Para los productos de países sin referencia, la licencia de clase B requiere la verificación de seguridad y funcionamiento a través de la información publicada o la investigación clínica y un certificado de venta libre del país de origen.
- Recopilación de la solicitud del producto (formulario MD-14), incluyendo y sin limitarse a la información de la planta de fabricación, la información técnica del producto, el certificación ISO 13485 y las instrucciones de uso.
- La solicitud de la licencia de registro o importación se debe presentar con la CDSCO junto con las tasas pertinentes y la documentación en inglés.
-
- La CDSCO evalúa las solicitudes y puede solicitar una presentación técnica.
- Un comité experto en el área (SEC) evalúa los productos nuevos.
- La CDSCO otorga una licencia de importación sin fecha de vencimiento a través del formulario MD-15. Por otro lado, los cargos para la retención de la licencia se abonan cada cinco años.
- Una vez autorizado por la CDSCO, el agente autorizado designado en la India (IAA) puede importar productos.
- Comercialización de los productos e IVD aprobados en India.
Clase C
- Designe un agente autorizado en India para representarlo en las interacciones con la CDSCO. Para gestionar el registro y la importación del producto en India, el agente autorizado debe tener una licencia válida para venta al por mayor (formularios 20B y 21B/21C) y un poder legal.
- El IAA debe tener una cuenta en el portal de la CDSCO.
- La clase C y los IVD requieren pruebas en el país (investigación clínica o evaluación clínica) a través del Instituto nacional de biología (NIB) o un laboratorio certificado de la India o aprobación de la CRO (Organización de investigación clínica) si no tienen la aprobación de un país de referencia.
- Recopilación de la solicitud del producto (formulario MD-14), incluyendo y sin limitarse a la información de la planta de fabricación, la información técnica del producto, el certificación ISO 13485 y las instrucciones de uso.
- La solicitud de la licencia de registro o importación se debe presentar con la CDSCO junto con las tasas pertinentes y la documentación en inglés.
-
- La CDSCO evalúa las solicitudes y puede solicitar una presentación técnica.
- Un comité experto en el área (SEC) evalúa los productos nuevos.
- La CDSCO otorga una licencia de importación sin fecha de vencimiento a través del formulario MD-15. Por otro lado, los cargos para la retención de la licencia se abonan cada cinco años.
- Una vez autorizado por la CDSCO, el agente autorizado designado en la India (IAA) puede importar productos.
- Comercialización de los productos e IVD aprobados en India.
Clase D
- Designe un agente autorizado en India para representarlo en las interacciones con la CDSCO. Para gestionar el registro y la importación del producto en India, el agente autorizado debe tener una licencia válida para venta al por mayor (formularios 20B y 21B/21C) y un poder legal.
- El IAA debe tener una cuenta en el portal de la CDSCO.
- La clase D y los IVD requieren pruebas en el país (investigación clínica o evaluación clínica) a través del Instituto nacional de biología (NIB) o un laboratorio certificado de la India o aprobación de la CRO (Organización de investigación clínica) si no tienen la aprobación de un país de referencia.
- Recopilación de la solicitud del producto (formulario MD-14), incluyendo y sin limitarse a la información de la planta de fabricación, la información técnica del producto, el certificación ISO 13485 y las instrucciones de uso.
- La solicitud de la licencia de registro o importación se debe presentar con la CDSCO junto con las tasas pertinentes y la documentación en inglés.
-
- La CDSCO evalúa las solicitudes y puede solicitar una presentación técnica.
- Un comité experto en el área (SEC) evalúa los productos nuevos.
- La CDSCO otorga una licencia de importación sin fecha de vencimiento a través del formulario MD-15. Por otro lado, los cargos para la retención de la licencia se abonan cada cinco años.
- Una vez autorizado por la CDSCO, el agente autorizado designado en la India puede importar productos.
- Comercialización de los productos e IVD aprobados en India.
Gestión del ciclo de vida del producto posaprobación
Freyr ayuda a los fabricantes extranjeros en la gestión del ciclo de vida del producto de principio a fin, incluyendo las actividades de posaprobación, tales como:
- Gestión de cambios posaprobación - modificaciones a los productos sanitarios existentes aprobados, como agregar nuevas variantes, accesorios, nuevas indicaciones de uso, entre otras.
- Mantenimiento de las aprobaciones y registros a través del pago a tiempo de las tasas administrativas y de registro.
- Renovación de licencias.
- Colaboración entre la CDSCO y el fabricante.
- Gestión de la importación.
Con entregas internacionales y un centro operativo en India, Freyr ofrece un amplio conocimiento del panorama normativo de la India. Con una estrategia normativa bien consolidada, Freyr ofrece servicios de normativa de principio a fin para las actividades de pre y poscomercialización de productos sanitarios.
Resumen
|
Tipo de producto |
Riesgo |
Clase de producto |
Auditoría de SGC |
Vías de regulación |
IAA |
Resultado final |
|
Producto sin notificar |
N/A |
N/A |
N/A |
Registro de productos en el portal SUGAM. |
SÍ |
Registro en la base de datos. |
|
Producto notificado |
Riesgo bajo |
A |
Parte 5 del MDR 2017 o certificación ISO 13485:2016. certificación ISO 13485:2016 |
Registro del producto |
SÍ |
Licencia de prueba / fabricación /préstamo / importación. |
|
Riesgo bajo a moderado |
B |
|||||
|
Riesgo moderado a alto |
C |
|||||
|
Riesgo alto |
D |
DID YOU KNOW?
- CDSCO extends timeline for licensing of nebulizers, BP monitoring devices, digital thermometers, and glucometers
- Click here to view the CDSCO update
- 30th June, 2021 is the deadline
Submit your Application now!
Resource Center
Blogs
Case Studies
Infographic
What is...?
LA EXPERIENCIA DE FREYR
- Servicios de inteligencia normativa y diligencia debida en la India.
- Clasificación de productos sanitarios y estrategia de grupos en la India.
- Representación de agente autorizado de la India (IAA).
- Creación de cuenta en SUGAM y gestión de la cuenta.
- Licencia de prueba para productos sanitarios e IVD.
- Licencia de importación para productos sanitarios e IVD.
- Licencia de fabricación para productos sanitarios e IVD regulados.
- Licencia de préstamo para productos sanitarios e IVD.
- Registro de productos sanitarios sin regular.
- Registro de la fábrica.
- Servicios de recopilación para los documentos de los productos y el archivo maestro de producto (DMF).
- Colaboración con la CDSCO, las autoridades de autorización centrales y estatales.
- Servicios de pruebas en el país.
- Seguimiento poscomercialización
- Aprobación AERB para productos de diagnóstico por radiación.