Indien CDSCO Registrierung von Medizinprodukten Übersicht
Indien zählt zu den wichtigsten globalen Märkten für Medizinprodukte und trägt maßgeblich zu deren Import bei. Die Central Drug Standard Control Organization (CDSCO) reguliert die in Indien vermarkteten Medizinprodukte und In-Vitro-Diagnostika (IVD). Die CDSCO wird vom Drug Controller General of India (DCGI) geleitet und die Genehmigungsbehörde ist zwischen der Center Licensing Authority (CLA) und der State Licensing Authority (SLA) aufgeteilt. Die indische CDSCO-Registrierung von Medizinprodukten erfordert die Einhaltung zahlreicher Vorschriften in Bezug auf die Klassifizierung von Produkten und die Standards für die Patientensicherheit.
Aufsichtsbehörde: Central Drug Standard Control Organization (CDSCO)
Regulierung: Medical Device Rules, 2017
Regulatorischer Weg: Produktauflistung oder Registrierung
Bevollmächtigter Vertreter: Autorisierter indischer Vertreter (IAA) für benannte sowie nicht benannte Produkte erforderlich
QMS-Anforderung: Anhang 5 der MDR 2017/ ISO 13485:2016
Bewertung der technischen Daten: CDSCO oder von CDSCO akkreditierte benannte Stellen
Gültigkeit der Lizenz: Unbegrenzt
Kennzeichnungsvorschriften: Kapitel VI der MDR 17, Gesetz über das gesetzliche Messwesen
Format der Einreichung: Online
Sprache: Englisch
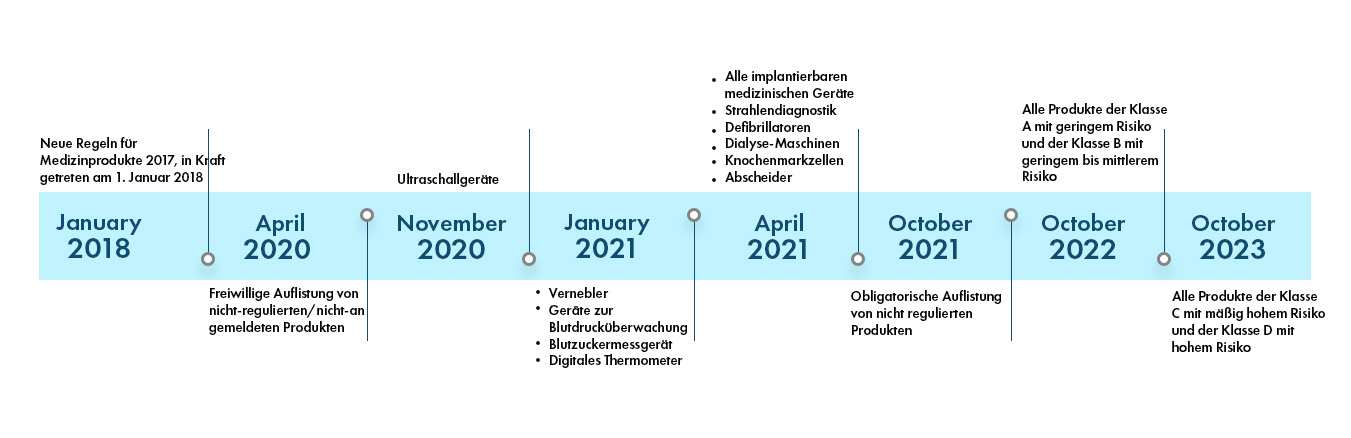
Die indischen Vorschriften für Medizinprodukte sind dynamisch und werden von Tag zu Tag strenger gestaltet. Derzeit gibt es 37 Kategorien von Produkten, die von der CDSCO in Indien gemeldet und reguliert werden. In den kommenden Jahren werden weitere Produktkategorien in den Geltungsbereich der CDSCO-Vorschriften aufgenommen. Die Regulierungslandschaft in Indien wird im Folgenden dargestellt:
Klassifizierung von Medizinprodukten in Indien
Es gibt getrennte Klassifizierungssysteme für Medizinprodukte und Invitro-Diagnostika (IVD). Jede dieser Kategorien wird in 4 Klassen eingeteilt, basierend auf dem Ausmaß des Risikos, das mit diesen Produkten verbunden ist.
|
Produktklasse |
Risiko |
|
A |
Geringes Risiko |
|
B |
Geringes mäßiges Risiko |
|
C |
Mäßiges – hohes Risiko |
|
D |
Hohes Risiko |
Autorisierter indischer Vertreter (IAA)
Ausländische Hersteller sollten einen Indian Authorized Agent (IAA) für die Vermarktung von Produkten in Indien ernennen. Der IAA muss über eine aktive Großhandelslizenz für Arzneimittel in den Antragsformularen 20B & 21B verfügen. Ausländische Hersteller können ihre Vertriebshändler oder Importeure als IAA benennen. Ein unabhängiger IAA, der keine kommerziellen Interessen verfolgt, bietet jedoch die nötige Flexibilität, um mehrere Vertriebshändler in Indien zu benennen. Klicken Sie hier, um mehr über die am häufigsten gestellte Frage zur Ernennung eines IAA zu erfahren.
Registrierung von Medizinprodukten in Indien
Alle Anträge sowohl für benannte als auch für nicht benannte Produkte müssen über das Online-Portal SUGAM eingereicht werden. Die CDSCO verwaltet die Anträge über dasselbe Portal.
Nicht benannte Produkte: Die Produkte, die nicht in der Liste der benannten Produkte aufgeführt sind, werden in Indien nicht reguliert. Diese Geräte werden jedoch im CDSCO-Portal aufgeführt. Ausländische Hersteller müssen über eine in Indien ansässige IAA verfügen, um diese Produkte zu vermarkten.
Benannte Produkte: Es gibt 37 Kategorien von Produkten, die in der Liste der benannten Produkte aufgeführt sind, die von der CDSCO reguliert werden und für deren Vermarktung in Indien eine vorherige Genehmigung der CDSCO erforderlich ist. Es gibt verschiedene Arten von Antragsformularen und die Anforderungen an die Dokumentation variieren mit dem Antragsformular, das bei der CDSCO eingereicht wird.
Die Wahl des Antrags hängt von der Zulassung im Heimatland, der Verfügbarkeit eines Free Sale Certificate (FSC), der Art des Antragstellers, der Geschäftstätigkeit und der Art des Produkts ab. Nach eingehender Prüfung der Anträge erteilt die CDSCO Lizenzen entweder für die Prüfung, den Import oder die Herstellung von Produkten.
|
Geplanter Betrieb |
Indischer Hersteller (eigene Mfg. Standort) |
Indischer Hersteller (Anderer Standort) |
Ausländischer Hersteller |
|
Herstellung von Produkte für den Vertrieb oder Verkauf |
Herstellungslizenz |
Leih-Lizenz |
NA |
|
Herstellung/Import von Produkten zu Testzwecken |
Test-Lizenz |
Test-Lizenz |
Test-Lizenz |
|
Import von Produkten für den Vertrieb in Indien (mit Genehmigung des Referenzlandes) |
NA |
NA |
Einfuhrlizenz ohne technische SEC-Bewertung |
|
Einfuhr von Produkten für den Vertrieb in Indien (ohne Genehmigung des Referenzlandes / FSC) |
NA |
NA |
Einfuhrlizenz mit technischer SEC-Bewertung |
Überblick über den regulatorischen Genehmigungsprozess
Klasse A NSNM
- Ernennen Sie einen Importeur, der Ihre Registrierung und den Import von Geräten in Indien verwaltet. Der Importeur muss eine gültige Großhandelslizenz (Formular 20B/21B oder Formular 41) besitzen oder eine gültige Begründung vorlegen, wenn er keine Lizenz besitzt.
- Der Importeur muss über ein Online-Konto auf dem CDSCO-Portal verfügen.
- Selbstdeklaration
- Obligatorische Registrierung des Produkts auf dem CDSCO-Portal
- Vermarktung der zugelassenen Produkte und IVDs in Indien
Klasse A
- Ernennung eines autorisierten Vertreters in Indien, der Sie bei den Verhandlungen mit der CDSCO vertritt. Der Bevollmächtigte muss im Besitz einer gültigen Großhandelslizenz (Formulare 20B und 21B/21C) sein und über eine Vollmacht verfügen, um Ihre Registrierung und den Import von Produkten in Indien zu verwalten.
- Der IAA muss über ein Online-Konto auf dem CDSCO-Portal verfügen.
- Für Produkte aus Nicht-Referenzländern erfordert die Lizenz der Klasse B eine Überprüfung der Sicherheit und Leistung durch veröffentlichte Daten/klinische Untersuchungen und ein Freiverkaufszertifikat aus dem Herkunftsland
- Zusammenstellung des Produktantrags (Formular MD-14), einschließlich, aber nicht beschränkt auf Informationen über die Herstellungseinrichtung, technische Informationen über das Produkt, ISO 13485-Zertifikat und IFU
- Der Antrag auf Registrierung/Importlizenz muss zusammen mit den entsprechenden Gebühren und Unterlagen in englischer Sprache bei der CDSCO eingereicht werden.
-
- Die CDSCO prüft den Antrag und kann eine technische Präsentation verlangen.
- Ein Fachexpertenausschuss (SEC) bewertet die neuartigen Produkte
- Die CDSCO erteilt mit dem Formular MD-15 eine Importlizenz ohne Verfallsdatum. Andererseits werden alle fünf Jahre Gebühren für die Aufrechterhaltung der Lizenz fällig.
- Sobald die CDSCO die Genehmigung erteilt hat, kann der ernannte India Authorized Agent (IAA) Produkte importieren.
- Vermarktung der zugelassenen Produkte und IVDs in Indien
Klasse B
- Ernennung eines autorisierten Vertreters in Indien, der Sie bei den Verhandlungen mit der CDSCO vertritt. Der Bevollmächtigte muss im Besitz einer gültigen Großhandelslizenz (Formulare 20B und 21B/21C) sein und über eine Vollmacht verfügen, um Ihre Registrierung und den Import von Produkten in Indien zu verwalten.
- Der IAA muss über ein Online-Konto auf dem CDSCO-Portal verfügen.
- Für Produkte aus Nicht-Referenzländern erfordert die Lizenz der Klasse B eine Überprüfung der Sicherheit und Leistung durch veröffentlichte Daten/klinische Untersuchungen und ein Freiverkaufszertifikat aus dem Herkunftsland
- Zusammenstellung des Produktantrags (Formular MD-14), einschließlich, aber nicht beschränkt auf Informationen über die Herstellungseinrichtung, technische Informationen über das Produkt, ISO 13485-Zertifikat und IFU
- Der Antrag auf Registrierung/Importlizenz muss zusammen mit den entsprechenden Gebühren und Unterlagen in englischer Sprache bei der CDSCO eingereicht werden.
-
- Die CDSCO prüft den Antrag und kann eine technische Präsentation verlangen.
- Ein Fachexpertenausschuss (SEC) bewertet die neuartigen Produkte
- Die CDSCO erteilt mit dem Formular MD-15 eine Importlizenz ohne Verfallsdatum. Andererseits werden alle fünf Jahre Gebühren für die Aufrechterhaltung der Lizenz fällig.
- Sobald die CDSCO die Genehmigung erteilt hat, kann der ernannte India Authorized Agent (IAA) Produkte importieren.
- Vermarktung der zugelassenen Produkte und IVDs in Indien
Klasse C
- Ernennung eines autorisierten Vertreters in Indien, der Sie bei den Verhandlungen mit der CDSCO vertritt. Der Bevollmächtigte muss im Besitz einer gültigen Großhandelslizenz (Formulare 20B und 21B/21C) sein und über eine Vollmacht verfügen, um Ihre Registrierung und den Import von Produkten in Indien zu verwalten.
- Der IAA muss über ein Online-Konto auf dem CDSCO-Portal verfügen.
- Klasse C und IVD erfordern Tests im Land (klinische Prüfung/klinische Bewertung) durch das National Institute of Biologicals (NIB) oder ein zertifiziertes indisches Labor oder eine zugelassene CRO (Clinical Research Organization), wenn sie keine Zulassung des Referenzlandes haben.
- Zusammenstellung des Produktantrags (Formular MD-14), einschließlich, aber nicht beschränkt auf Informationen über die Herstellungseinrichtung, technische Informationen über das Produkt, ISO 13485-Zertifikat und IFU
- Der Antrag auf Registrierung/Importlizenz muss zusammen mit den entsprechenden Gebühren und Unterlagen in englischer Sprache bei der CDSCO eingereicht werden.
-
- Die CDSCO prüft den Antrag und kann eine technische Präsentation verlangen.
- Ein Fachexpertenausschuss (SEC) bewertet die neuartigen Produkte
- Die CDSCO erteilt mit dem Formular MD-15 eine Importlizenz ohne Verfallsdatum. Andererseits werden alle fünf Jahre Gebühren für die Aufrechterhaltung der Lizenz fällig.
- Sobald die CDSCO die Genehmigung erteilt hat, kann der ernannte India Authorized Agent (IAA) Produkte importieren.
- Vermarktung der zugelassenen Produkte und IVDs in Indien
Klasse D
- Ernennung eines autorisierten Vertreters in Indien, der Sie bei den Verhandlungen mit der CDSCO vertritt. Der Bevollmächtigte muss im Besitz einer gültigen Großhandelslizenz (Formulare 20B und 21B/21C) sein und über eine Vollmacht verfügen, um Ihre Registrierung und den Import von Produkten in Indien zu verwalten.
- Der IAA muss über ein Online-Konto auf dem CDSCO-Portal verfügen.
- Klasse D und IVD erfordern Tests im Land (klinische Prüfung/ klinische Bewertung) durch das National Institute of Biologicals (NIB) oder ein zertifiziertes indisches Labor oder eine zugelassene CRO (Clinical Research Organization), wenn sie keine Zulassung des Referenzlandes haben.
- Zusammenstellung des Produktantrags (Formular MD-14), einschließlich, aber nicht beschränkt auf Informationen über die Herstellungseinrichtung, technische Informationen über das Produkt, ISO 13485-Zertifikat und IFU
- Der Antrag auf Registrierung/Importlizenz muss zusammen mit den entsprechenden Gebühren und Unterlagen in englischer Sprache bei der CDSCO eingereicht werden.
-
- Die CDSCO prüft den Antrag und kann eine technische Präsentation verlangen.
- Ein Fachexpertenausschuss (SEC) bewertet die neuartigen Produkte
- Die CDSCO erteilt mit dem Formular MD-15 eine Importlizenz ohne Ablaufdatum. Andererseits werden alle fünf Jahre Gebühren für die Aufrechterhaltung der Lizenz fällig.
- Sobald die CDSCO die Genehmigung erteilt hat, kann der ernannte India Authorized Agent Produkte importieren.
- Vermarktung der zugelassenen Produkte und IVDs in Indien
Post Approval Device Life Cycle Management
Freyr unterstützt ausländische Hersteller beim End-to-End-Management des Lebenszyklus von Medizinprodukten, einschließlich Aktivitäten nach der Zulassung, wie z.B.:
- Änderungsmanagement nach der Zulassung - Änderungen an bestehenden Zulassungen für Medizinprodukte, wie z. B. Hinzufügen neuer Varianten, Zubehör, Hinzufügen neuer Anwendungsgebiete usw.
- Aufrechterhaltung von Zulassungen und Registrierungen durch rechtzeitige Zahlung von Verwaltungs- und Registrierungsgebühren
- Erneuerung von Lizenzen
- Vermittlung zwischen der CDSCO und dem Hersteller
- Verwaltung der Importe
Mit einem eigenen globalen Liefer- und Betriebszentrum in Indien verfügt Freyr über umfassende Kenntnisse der indischen Regulierungslandschaft. Mit einer gut durchdachten Regulierungsstrategie bietet Freyr umfassende Regulierungsdienstleistungen für die Aktivitäten vor und nach der Markteinführung von Medizinprodukten.
Zusammenfassung
|
Art des Produktes |
Risiko |
Produktklasse |
QMS-Audit |
Regulatorischer Weg |
IAA |
Endgültiges Ergebnis |
|
Nicht benanntes Produkt |
NA |
NA |
NA |
Auflistung der Produkte im SUGAM-Portal |
JA |
Auflistung in der Datenbank |
|
Benanntes Produkt |
Geringes Risiko |
A |
Anhang 5 der MDR 2017 oder ISO 13485:2016Zertifizierung |
Registrierusng des Produktes |
JA |
Prüfung/Herstellung/Darlehen/Einfuhrlizenz |
|
Geringes - mäßiges Risiko |
B |
|||||
|
Mäßiges – hohes Risiko |
C |
|||||
|
Hohes Risiko |
D |
DID YOU KNOW?
- CDSCO extends timeline for licensing of nebulizers, BP monitoring devices, digital thermometers, and glucometers
- Click here to view the CDSCO update
- 30th June, 2021 is the deadline
Submit your Application now!
Resource Center
Blogs
Case Studies
Infographic
What is...?
Freyr EXPERTISE
- Regulatory Intelligence und Due-Diligence-Dienstleistungen in Indien
- Klassifizierung und Gruppierungsstrategie für Medizinprodukte in Indien
- Vertretung als Indischer Bevollmächtigter (IAA)
- SugaM-Kontoerstellung und -Kontoverwaltung
- Prüflizenz für Medizinprodukte und IVDs
- Einfuhrlizenz für regulierte Medizinprodukte und IVDs
- Herstellungslizenz für regulierte Medizinprodukte und IVDs
- Leih-Lizenz für regulierte Medizinprodukte und IVDs
- Auflistung der nicht regulierten Medizinprodukte
- Registrierung der Produktionsstätte
- Kompilierungsdienste für Gerätedokumente und Device Master File (DMF)
- Zusammenarbeit mit der CDSCO, den zentralen und den staatlichen Zulassungsbehörden
- Prüfdienste im Land
- Post-Market-Überwachung
- AERB-Zulassung für Strahlendiagnostikgeräte