Aperçu de l'enregistrement des dispositifs médicaux par le CDSCO Inde
L'Inde est considérée comme l'un des principaux marchés mondiaux de dispositifs médicaux, avec une contribution majeure des importations de dispositifs. La Central Drug Standard Control Organization (CDSCO) réglemente les dispositifs médicaux et les diagnostics in vitro (DIV) commercialisés en Inde. Le CDSCO est dirigé par le Drug Controller General of India (DCGI) et l'autorité d'approbation est partagée entre la Center Licensing Authority (CLA) et la State Licensing Authority (SLA). L'enregistrement des dispositifs médicaux auprès de la CDSCO Inde nécessite le respect de nombreuses réglementations relatives à la classification des dispositifs et aux normes de sécurité des patients.
Autorité de régulation : Organisation centrale de contrôle des normes pharmaceutiques (CDSCO)
Régulation : Règles relatives aux dispositifs médicaux, 2017
Mécanisme de régulation : Inscription ou enregistrement d'un dispositif
Représentant agréé : L'agent indien agréé (IAA) est requis pour les dispositifs notifiés et non notifiés.
Exigence du SMQ : Annexe 5 du MDR 2017/ ISO 13485:2016
Évaluation des données techniques : CDSCO ou organismes notifiés accrédités par le CDSCO
Validité de la licence : Illimitée
Exigences en matière d'étiquetage : Chapitre VI du MDR 17, Legal Metrology Act (loi sur la métrologie légale)
Format d'envoi : En ligne
Langue : Anglais
La réglementation indienne sur les dispositifs médicaux est dynamique et devient de plus en plus stricte. Il existe 37 catégories de dispositifs qui sont actuellement notifiés et réglementés par la CDSCO en Inde. D'autres catégories de dispositifs entreront dans le champ d'application du règlement CDSCO dans les années à venir. Le paysage réglementaire en Inde est décrit ci-dessous :
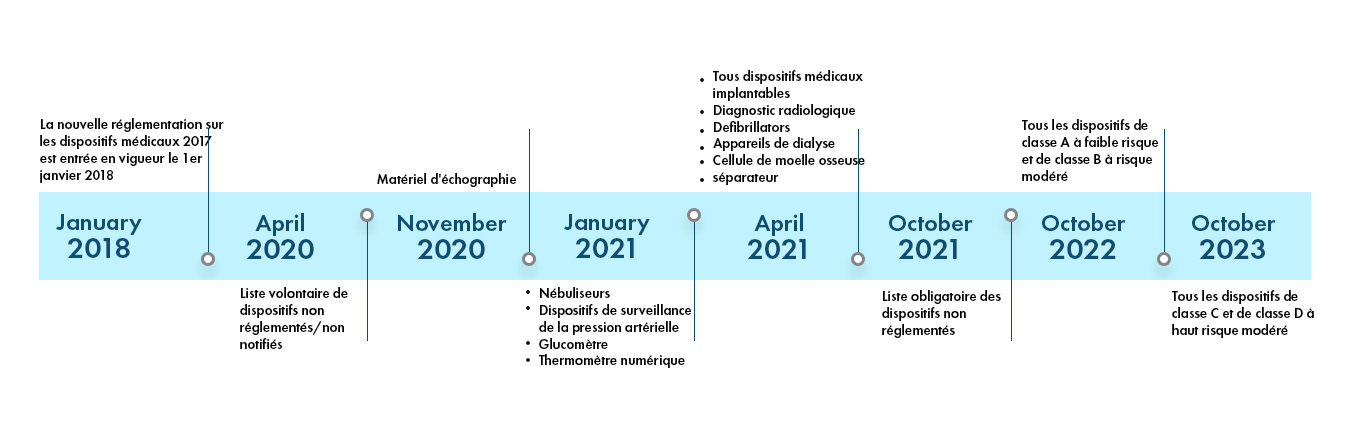
Classification des dispositifs médicaux en Inde
Il existe des systèmes de classification distincts pour les dispositifs médicaux et les dispositifs de diagnostic in vitro (IVD). Chacune de ces catégories est classée en 4 classes en fonction de l'importance du risque associé à ces dispositifs.
|
Classe de dispositif |
Risque |
|
A |
Faible risque |
|
B |
Risque Modéré faible |
|
C |
Risque modéré – élevé |
|
D |
Risque élevé |
Agent indien agréé(AIA)
Les fabricants étrangers doivent désigner un agent indien agréé (AIA) pour commercialiser les dispositifs en Inde. L'AIA doit posséder une licence active de vente en gros de médicaments dans les formulaires de demande 20B et 21B. Les fabricants étrangers peuvent désigner leurs distributeurs ou importateurs comme AIA. Toutefois, l'existence d'un AIA indépendant, sans intérêt commercial, offrirait la souplesse nécessaire pour nommer plusieurs distributeurs en Inde. Cliquez ici pour en savoir plus sur la question la plus fréquente concernant la désignation d'un AIA.
Enregistrement des dispositifs médicaux en Inde
Toutes les demandes pour les dispositifs notifiés et non notifiés doivent être soumises via le site en ligne SUGAM et le CDSCO gère les demandes via le même site.
Dispositifs non notifiés : Les dispositifs qui ne figurent pas sur la liste des dispositifs notifiés ne sont pas réglementés en Inde. Toutefois, ces dispositifs doivent être répertoriés dans le site du CDSCO. Les fabricants étrangers doivent disposer d'un AIA basée en Inde pour commercialiser ces appareils.
Dispositifs notifiés : Il existe 37 catégories de dispositifs figurant sur la liste notifiée, qui sont réglementées par le CDSCO et dont la commercialisation en Inde nécessite l'approbation préalable du CDSCO. Il existe différents types de formulaires de demande et les exigences en matière de documentation varient en fonction du formulaire de demande soumis au CDSCO.
Le choix de l'application varie en fonction de l'approbation du pays d'origine, de la disponibilité d'un certificat de vente libre (CVL), de la nature du demandeur, des opérations et du type de dispositif. Après une évaluation détaillée des demandes, le CDSCO délivre des licences pour soit l'essai, l'importation ou la fabrication de dispositifs.
|
Utilisation prévue |
Fabricant indien (own Mfg. Site) |
Fabricant indien (Autres sites) |
Fabricant étranger |
|
Fabrication de dispositifs pour la distribution ou la vente |
Licence de fabrication |
Licence de prêt |
NA |
|
Fabrication de dispositifs / Importation à des fins d’essai |
Licence d'essai |
Licence d'essai |
Licence d'essai |
|
Importation de dispositifs pour distribution en Inde (avec l'approbation du pays de référence) |
NA |
NA |
Licence d'importation sans évaluation technique de la SEC |
|
Importation de dispositifs pour distribution en Inde (sans approbation du pays de référence / FSC) |
NA |
NA |
Licence d'importation avec évaluation technique de la SEC |
Aperçu du processus d'approbation réglementaire
Classe A NSNM
- Désigner un importateur pour gérer votre enregistrement et l'importation des dispositifs en Inde. L'importateur doit disposer d'une licence de grossiste valide (formulaire 20B/21B ou formulaire 41) ou fournir une justification valide s'il ne dispose pas d'une licence.
- L'importateur doit disposer d'un compte en ligne sur le site du CDSCO.
- Auto-déclaration
- Enregistrement obligatoire du produit sur le site du CDSCO
- Commercialisation des dispositifs homologués et des IVD en Inde
Classe A
- Désigner un agent agréé pour l'Inde qui vous représentera dans vos relations avec le CDSCO. Pour gérer votre enregistrement et l'importation de vos dispositifs en Inde, l'agent agréé doit être titulaire d'une licence de vente en gros valide (formulaires 20B et 21B/21C) et disposer d'une procuration.
- L'AIA doit disposer d'un compte en ligne sur le site du CDSCO.
- Pour les dispositifs provenant de pays non référencés, l'autorisation de classe B requiert une vérification de la sécurité et des performances par le biais de données publiées ou d'investigations cliniques, ainsi qu'un certificat de vente libre du pays d'origine.
- Compilation de la demande de dispositif (formulaire MD-14), y compris, mais sans s'y limiter, les informations sur l'installation de l’usine de fabrication, les informations techniques sur le dispositif, le certificat ISO 13485 et l'IFU.
- La demande d'enregistrement/de licence d'importation doit être déposée auprès du CDSCO, accompagnée des taxes et de la documentation nécessaires, en anglais.
-
- Le CDSCO évalue la demande et peut solliciter une présentation technique.
- Un comité d'experts (SEC) évalue les nouveaux dispositifs.
- Le CDSCO délivre une licence d'importation sans date d'expiration au moyen du formulaire MD-15. En revanche, les frais de conservation des licences sont payables tous les cinq ans.
- Une fois autorisé par le CDSCO, l'agent indien agréé (AIA) peut importer des produits.
- Commercialisation des dispositifs homologués et des IVD en Inde
Classe B
- Désigner un agent agréé indien pour vous représenter dans les interactions avec le CDSCO. Pour gérer votre enregistrement et l'importation de vos dispositifs en Inde, l'agent agréé doit être titulaire d'une licence de grossiste valide (formulaires 20B et 21B/21C) et disposer d'une procuration.
- L'AIA doit disposer d'un compte en ligne sur le site du CDSCO.
- Pour les dispositifs provenant de pays non référencés, l'autorisation de classe B requiert une vérification de la sécurité et des performances par le biais de données publiées ou d'investigations cliniques, ainsi qu'un certificat de vente libre du pays d'origine.
- Compilation de la demande de dispositif (formulaire MD-14), y compris, mais sans s'y limiter, les informations sur l'installation de l’usine de fabrication, les informations techniques sur le dispositif, le certificat ISO 13485 et l'IFU.
- La demande d'enregistrement/de licence d'importation doit être déposée auprès du CDSCO, accompagnée des taxes et de la documentation nécessaires, en anglais.
-
- Le CDSCO évalue la demande et peut solliciter une présentation technique.
- Un comité d'experts (SEC) évalue les nouveaux dispositifs.
- Le CDSCO délivre une licence d'importation sans date d'expiration au moyen du formulaire MD-15. En revanche, les frais de conservation des licences sont payables tous les cinq ans.
- Une fois autorisé par le CDSCO, l'agent indien agréé (AIA) peut importer des produits.
- Commercialisation des dispositifs homologués et des IVD en Inde
Classe C
- Désigner un agent agréé pour l'Inde qui vous représentera dans vos relations avec le CDSCO. Pour gérer votre enregistrement et l'importation de vos dispositifs en Inde, l'agent agréé doit être titulaire d'une licence de grossiste valide (formulaires 20B et 21B/21C) et disposer d'une procuration.
- L'AIA doit disposer d'un compte en ligne sur le site du CDSCO.
- La classe C et les IVD doivent être testés dans le pays (investigation clinique/évaluation clinique) par l'intermédiaire du National Institute of Biologicals (NIB) ou d'un laboratoire indien certifié ou d'un CRO (Clinical Research Organization) agréé s'ils n'ont pas été approuvés par le pays de référence.
- Compilation de la demande de dispositif (formulaire MD-14), y compris, mais sans s'y limiter, les informations sur l'installation de l’usine fabrication, les informations techniques sur le dispositif, le certificat ISO 13485 et l'IFU.
- La demande d'enregistrement/de licence d'importation doit être déposée auprès du CDSCO, accompagnée des taxes et de la documentation nécessaires, en anglais.
-
- Le CDSCO évalue la demande et peut solliciter une présentation technique.
- Un comité d'experts (SEC) évalue les nouveaux dispositifs.
- Le CDSCO délivre une licence d'importation sans date d'expiration au moyen du formulaire MD-15. Par contre, les frais de conservation des licences sont payables tous les cinq ans.
- Une fois autorisé par le CDSCO, l'agent indien agréé (AIA) peut importer des produits.
- Commercialisation des dispositifs homologués et des IVD en Inde
Classe D
- Désigner un agent agréé pour l'Inde qui vous représentera dans vos interactions avec le CDSCO. Pour gérer votre enregistrement et l'importation de vos dispositifs en Inde, l'agent autorisé doit être titulaire d'une licence de grossiste en cours de validité (formulaires 20B et 21B/21C) et avoir reçu une procuration.
- L'AIA doit disposer d'un compte en ligne sur le site du CDSCO.
- La classe D et les IVD doivent être testés dans le pays (investigation clinique/évaluation clinique) par l'intermédiaire du National Institute of Biologicals (NIB) ou d'un laboratoire indien certifié ou d'un CRO (Clinical Research Organization) agréé s'ils n'ont pas été approuvés par le pays de référence.
- Compilation de la demande de dispositif (formulaire MD-14), y compris, mais sans s'y limiter, les informations sur l'installation de l’usine de fabrication, les informations techniques sur le dispositif, le certificat ISO 13485 et l'IFU.
- La demande d'enregistrement/de licence d'importation doit être déposée auprès du CDSCO, accompagnée des taxes et de la documentation nécessaires, en anglais.
-
- Le CDSCO évalue la demande et peut solliciter une présentation technique.
- Un comité d'experts (SEC) évalue les nouveaux dispositifs.
- Le CDSCO délivre une licence d'importation sans date d'expiration au moyen du formulaire MD-15. En revanche, les frais de conservation de la licence sont payables tous les cinq ans.
- Une fois autorisé par le CDSCO, l'agent agréé indien désigné peut importer des produits.
- Commercialisation des dispositifs homologués et des IVD en Inde
Gestion du cycle de vie des appareils après leur approbation
Freyr soutient les fabricants étrangers dans la gestion de bout en bout du cycle de vie des dispositifs médicaux, y compris les activités post-approbation, telles que :
- Gestion des modifications post-approbation - modifications apportées aux dispositifs médicaux déjà homologués, telles que l'ajout de nouvelles variantes, d'accessoires, de nouvelles indications d'utilisation, etc.
- Maintien des agréments et de l'enregistrement par le paiement en temps voulu des frais administratifs et d'enregistrement
- Renouvellement des licences
- Assurer la liaison entre le CDSCO et le fabricant
- Gestion des importations
Avec un centre de livraison et d'exploitation en Inde, Freyr dispose d'une connaissance approfondie du paysage réglementaire indien. Grâce à une stratégie réglementaire bien élaborée, Freyr fournit des services réglementaires de bout en bout pour les activités de pré-commercialisation et de post-commercialisation des dispositifs médicaux.
Synthèse
|
Type de dispositif |
Risque |
Classe de dispositif |
Audit du SMQ |
Mécanisme de régulation |
AIA |
Résultat final |
|
Dispositif non notifié |
NA |
NA |
NA |
Enregistrement des dispositifs dans le site SUGAM |
Yes |
Inscription dans la base de données |
|
Dispositif notifié |
Faible risque |
A |
Annexe 5 du MDR 2017 ou certificationcertification ISO 13485:2016 |
Enregistrement du dispositif |
OUI |
Test / Fabrication / Prêt / Licence d'importation |
|
Risque modéré – faible |
B |
|||||
|
Risque modéré – élevé |
C |
|||||
|
Risque élevé |
D |
DID YOU KNOW?
- CDSCO extends timeline for licensing of nebulizers, BP monitoring devices, digital thermometers, and glucometers
- Click here to view the CDSCO update
- 30th June, 2021 is the deadline
Submit your Application now!
Resource Center
Blogs
Case Studies
Infographic
What is...?
EXPERTISE DE FREYR
- Services de veille réglementaire et de diligence raisonnable en Inde
- Classification des dispositifs médicaux et stratégie de regroupement en Inde
- Représentation de l'agent indien autorisé (AIA)
- Création et gestion d'un compte SUGAM
- Licence d'essai pour les dispositifs médicaux et les IVD
- Licence d'importation pour les dispositifs médicaux réglementés et les IVD
- Licence de fabrication pour les dispositifs médicaux réglementés et les IVD
- Licence de prêt pour les dispositifs médicaux réglementés et les IVD
- Inscription des dispositifs médicaux non réglementés
- Enregistrement des sites de fabrication
- Services de compilation des documents relatifs aux dispositifs et du fichier principal des dispositifs (DMF)
- Assurer la liaison avec le CDSCO, les autorités centrales et les autorités nationales en charge de l'octroi des licences.
- Services d'essai dans le pays
- Surveillance post-commercialisation
- Approbation de l'AERB pour les dispositifs de radiodiagnostic